ICH Q14 desarrollo de métodos analíticos y el impacto sobre ICH Q2 validación de métodos analíticos
Uno de los procesos GxP relevantes dentro de la industria es el proceso de validación de método analíticos. La importancia esencial es su vinculación directa con el método analítico utilizado de rutina (Liberaciones, Estabilidades). Con la actualización “propuesta” por parte de ICH, en lo referente a los procesos analíticos de desarrollo y validación se busca que estos tengan una relación estrecha en el que el beneficio principal es la calidad por diseño y mantenimiento del estado validado.
Como bien sabemos, el objetivo de la validación de procedimientos analíticos es demostrar que el procedimiento es adecuado para el fin previsto. Sin perder de vista que los datos y resultados deben ser suficientemente confiables para la toma de decisiones.
Un estudio de validación está diseñado para proporcionar pruebas suficientes de que el procedimiento analítico cumple sus objetivos. Estos objetivos se describen con un conjunto adecuado de características de rendimiento correspondientes, que pueden variar en función de uso previsto del procedimiento analítico y la tecnología especifica seleccionada.
Con la reciente propuesta de la guía ICHQ14 se busca incluir, describir y robustecer el proceso de laboratorio por la estrecha relación que existe entre el desarrollo de métodos y la validación de estos. Con esto podremos visualizar términos como son: estrategia de validación y control, ciclo de vida y mantenimiento como parte esencial de esta. Sin perder de vista la inclusión de metodologías existentes, tales cuales no eran claramente abordadas.
La propuesta ICH Q14 atribuye que dicho proceso y los conocimientos arrojados por este, se controlen de tal manera que se pueda obtener la información sobre la finalidad prevista del procedimiento analítico, y el rendimiento de las características y criterios asociados que deben ser validados.
La siguiente figura muestra cómo se puede generar el conocimiento durante el desarrollo de un procedimiento analítico propuesto en la ICHQ14 y con esto ayudar al diseño de un estudio de validación.
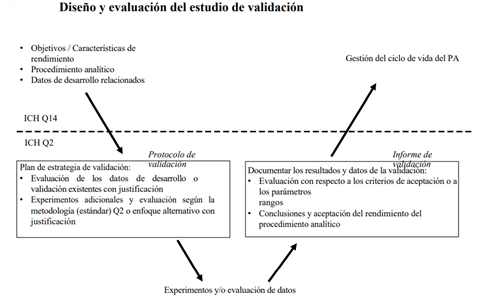
Validación durante el ciclo de vida de un procedimiento analítico
Durante el ciclo de vida de un procedimiento analítico pueden ser necesarios cambios. En tales casos, los cambios parciales pueden necesitar una revalidación completa. La ciencia y los principios basados en el riesgo pueden utilizarse para justificar sin una determinada característica de rendimiento necesita o no revalidación. El alcance de la revalidación depende de las características de rendimiento analítico afectadas por el cambio.
Consideraciones generales para el desarrollo de procedimientos analíticos y la gestión del ciclo de vida
El objetivo del desarrollo es obtener un procedimiento analítico adecuado para su propósito: medir un atributo o atributos del material analizado con la especificidad/selectividad, exactitud y/o precisión en el intervalo notificable. En esta sección se describen los enfoques mínimo y mejorado del desarrollo de procedimientos analíticos En esta sección se describen los enfoques mínimo y mejorado para el desarrollo de procedimientos analíticos. Aunque el enfoque mínimo sigue siendo aceptable, algunos o todos los elementos del enfoque mejorado de este enfoque mejorado para apoyar el desarrollo y la gestión del ciclo de vida de los procedimientos analíticos.
En ciertos casos, un procedimiento analítico establecido puede aplicarse a múltiples productos con poca o ninguna modificación de las condiciones de medición. Para una nueva aplicación de dichos procedimientos analíticos de plataforma plataforma, el desarrollo posterior puede abreviarse y algunas pruebas de validación puede omitirse sobre la base de una justificación científica y de riesgo. Los detalles de las características de rendimiento consideradas para la validación de procedimientos analíticos se describen en la ICH Q2.
En general, los datos obtenidos durante los estudios de desarrollo (por ejemplo, los datos de robustez de un diseño de de experimentos (estudio DoE)) pueden utilizarse como datos de validación para las características de rendimiento del procedimiento analítico características de rendimiento del procedimiento analítico y no es necesario repetirlos.
Enfoques mínimos frente a enfoques mejorados para el desarrollo de procedimientos analíticos
Enfoque mínimo.
El desarrollo de procedimientos analíticos debe incluir los siguientes elementos, según corresponda:
- Identificación de los atributos de la sustancia o el producto farmacéutico que deben ser analizados por el procedimiento analítico.
- Selección de una tecnología de procedimiento analítico apropiada y de los instrumentos o aparatos adecuados.
- Llevar a cabo estudios de desarrollo apropiados para evaluar el rendimiento del procedimiento analítico
- características de rendimiento del procedimiento analítico, como la especificidad, la exactitud y la precisión en el intervalo notificable (incluyendo el modelo de calibración, los límites en los extremos del rango inferior y/o superior) y la solidez.
- Definir una descripción adecuada del procedimiento analítico que incluya la estrategia de control estrategia de control del procedimiento analítico (por ejemplo, ajustes de los parámetros y adecuación del sistema).
Enfoque mejorado
El enfoque mejorado ofrece una forma sistemática de desarrollar y perfeccionar el conocimiento de un procedimiento analítico. Un enfoque mejorado debe incluir uno o más de los siguientes elementos, además de los ya descritos para el enfoque mínimo:
- Una evaluación de las propiedades de la muestra y de la variabilidad esperada de la muestra basada en conocimiento del proceso de fabricación.
- Definición del perfil analítico objetivo.
- Realización de una evaluación de riesgos y evaluación de los conocimientos previos para identificar los parámetros del procedimiento analítico que pueden afectar al rendimiento del procedimiento.
- Realización de experimentos uni o multivariados para explorar los rangos y las interacciones entre parámetros identificados del procedimiento analítico.
- Definir una estrategia de control del procedimiento analítico basada en una mejor comprensión del procedimiento incluyendo los puntos de ajuste y/o rangos apropiados para los parámetros relevantes del procedimiento analítico garantizando el cumplimiento de los criterios de rendimiento.
Definir un plan de gestión de cambios del ciclo de vida con definiciones claras y categorías de información de condiciones establecidas, rangos aceptables probados o regiones de diseño operacional del método según proceda. La aplicación de elementos del enfoque mejorado al desarrollo puede conducir a procedimientos analíticos más sólidos, a una mejor comprensión del impacto de los parámetros del procedimiento analítico y a una mayor flexibilidad para la gestión del ciclo de vida, como rangos operativos más amplios, un conjunto más apropiado de condiciones establecidas y categorías de información asociadas para los cambios.
El enfoque mejorado ofrece potencialmente varias ventajas, entre ellas
- Comprensión de aquellos atributos del procedimiento analítico tales cuales son esenciales para el rendimiento del procedimiento.
- Mejorar el control de los procedimientos analíticos para conseguir un funcionamiento más fiable.
- Permitir medidas preventivas y facilitar la mejora continua mediante el uso de más conocimiento de los procedimientos analíticos.
- Reducir la cantidad de esfuerzo a lo largo del ciclo de vida del procedimiento analítico.
El ciclo de vida del procedimiento analítico
La siguiente figura muestra los elementos del ciclo de vida del procedimiento analítico.
El desarrollo de procedimientos analíticos y los enfoques de gestión de cambios se describen en esta directriz, mientras que la validación de los procedimientos analíticos se describe en la ICH Q2. Dependiendo del uso previsto del procedimiento analítico y del enfoque de desarrollo adoptado, el orden y el alcance de cada elemento pueden variar, y varios elementos pueden darse simultáneamente.

Estrategia de control del procedimiento analítico
Una estrategia de control de procedimientos analíticos debe garantizar que el procedimiento analítico funcione como esperado durante su uso rutinario a lo largo de su ciclo de vida y consiste en un conjunto de controles, derivados de la comprensión actual del procedimiento analítico, incluidos los datos de desarrollo, la evaluación de riesgos y la robustez. El conocimiento previo también podría utilizarse para desarrollar la estrategia de control del procedimiento analítico.
La estrategia de control del procedimiento analítico debe definirse antes de la validación (ICH Q2) y debe confirmarse una vez finalizada la validación.
La estrategia de control del procedimiento analítico incluye los parámetros del procedimiento analítico que necesitan control y la prueba de idoneidad del sistema que forma parte de la descripción del procedimiento analítico. La descripción del procedimiento analítico debe incluir los pasos necesarios para realizar cada prueba analítica. Esto puede incluir (pero no se limita a) la muestra, los materiales de referencia y los reactivos, la preparación de la muestra y de control, el uso del aparato, la generación de la curva de calibración, el uso de las fórmulas con herramientas para el cálculo de los resultados notificables y otros pasos necesarios. El nivel de detalle debe permitir a un analista experto realizar el análisis e interpretar los resultados (como el nivel de detalle en una farmacopea regional para una sustancia similar). Esto se denomina comúnmente comprobación de la calidad de los datos. Se recomienda un seguimiento continuo de los resultados de los procedimientos analíticos seleccionados para buscar cualquier tendencia, de acuerdo con las expectativas. La revisión de los resultados de los procedimientos analíticos facilita la gestión del ciclo de vida del procedimiento y permite una intervención proactiva para evitar fallos.
El desafío en la revisión y mantenimiento del estado validado
La directriz ICH 14 establece de manera concisa la relación que existe entre el desarrollo de métodos, el proceso de validación y el mantenimiento del ciclo de vida con un enfoque en Calidad. Sin embargo, uno de los desafíos que enfrentamos en el día a día y llegado el momento es aquella que relaciona la obtención, disponibilidad y compilación de la información para realizar la revisión de estado validado. Sin duda la estructuración de herramientas informáticas que ayuden a mostrar y recuperar la información contenida un solo punto será de gran ayuda para dar cumplimiento a un proceso que requiere una comprensión absoluta del comportamiento y desempeño de un método analíticos durante todo su ciclo de vida.
Los alcances tecnológicos manifiestan avances de gestión que favorecen la mejora continua y el desempeño de las actividades de laboratorio.
La gestión y mantenimiento desde una perspectiva tecnológica se precisa de la siguiente manera:
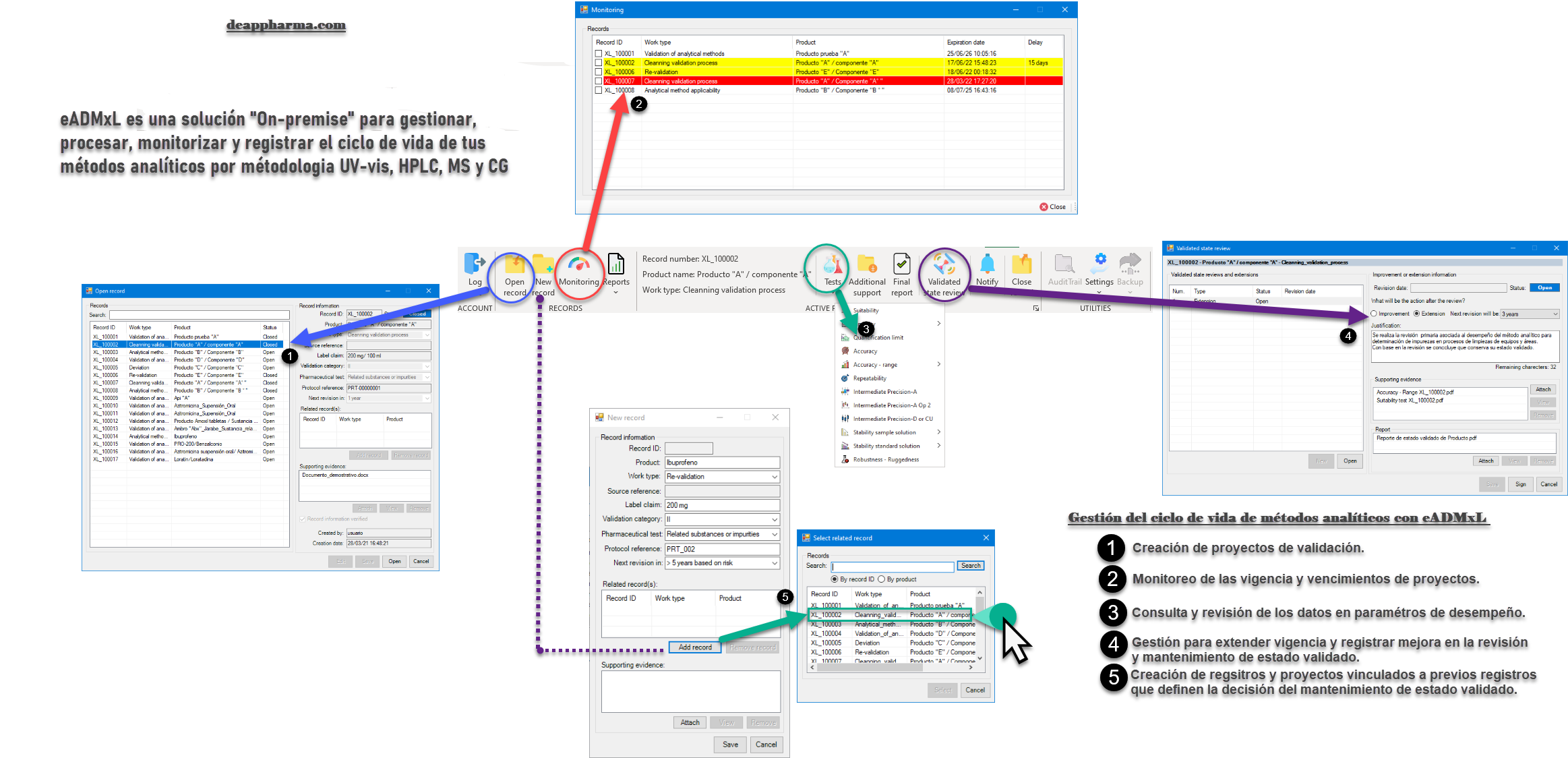
No olvides que, en caso de ser necesario, puedes contactarnos para mejorar el proceso de laboratorio y administrativo de tu organización a través software 100% confiable y seguro. Recuerda que en deappharma contamos con un software que te ayudara a controlar tu proceso de validación de métodos analíticos. Somos expertos en la materia, por lo que procesos complejos no representa un reto para nosotros, debido a que tenemos en mente los aspectos relevantes de cumplimiento.
Referencias
-
Analytical procedure development Q14 Draft version Endorsed on 24 March 2022
-
Validation of analytical procedures Q2(R2) Draft version Endorsed on 24 March 2022
¡Contáctanos! y conoce de que manera te vamos a ayudar.
¡Únete a nuestra comunidad en redes!
