Registros electrónicos (Identificadores)
Cuando se gestionan documentos o datos de laboratorio dentro de la industria regulada una función importante dentro del entorno de las buenas prácticas de laboratorio en sistemas computarizados e informatizados es aquel relacionado al control de registros. Visto desde una parte de trazabilidad este identificador es la base de búsqueda de algún documento y/o el comienzo para vincular acciones preestablecidas ya que es de carácter único.
Este articulo estará enfocado hacia el proceso de validación de métodos analíticos, sin embargo el concepto general aplica a diferentes esquemas de software eg, sistemas documentales, datos de laboratorio y hojas de cálculo.
Para comenzar con este articulo compartimos las siguientes definiciones, tales cuales anteceden la esencia de estas líneas.
Como definiciones para el proceso de validación de métodos analíticos establecidas por FDA y USP, respectivamente son;
FDA: “La validación de un método analítico es el proceso por el cual se establece, mediante estudios de laboratorio, que las características de desempeño del método cumplen con los requisitos para las aplicaciones analíticas previstas.”
USP: “La validación de métodos, es el proceso por el cual se demuestra que los procedimientos analíticos son aptos para el uso indicado.”
Como se puede percibir en las definiciones anteriores sobre la validación de métodos analíticos, se haca referencia a la palabra “PROCESO”. La definición de proceso se expresa de la siguiente manera: procesamiento o conjunto de operaciones a que se somete una cosa para elaborarla o transformarla.
Como bien sabemos los procesos de validación de métodos analíticos actualmente son realizados con el uso de hojas de cálculo, donde podemos encontrar varios gaps de integridad de datos. Bajo esta situación el control de registros depende de la clave que se asigna al protocolo de validación correspondiente y por ende el sitio donde se almacena la carpeta física con resultados.
Durante nuestra experiencia hemos observado diferentes situaciones desafortunadas para acceder a la información con procesos de gestión actual, los más representativos son:
- La información no se encuentra en el sitio ubicado destinado en el archivo muerto.
- La información impresa se extrajo y nunca se regresó a su sitio.
- La información impresa se puede destruir y generar un reporte nuevo sin posibilidad de trazar la existencia del primer documento.
Derivado de las situaciones anteriores no solo se observa un impacto sobre los documentos y/o datos de laboratorio. Lo que se impacta de manera esencial es la integridad de los datos y la toma de decisiones.
¿Cómo se impacta la integridad?
La integridad se ve impactada por la falta de control sobre datos y registros. Recordemos que la integridad de datos define que los datos y documentos deben ser perdurables para que estos se mantengan: atribuibles, legibles, contemporáneos y exactos. Por ende, la manera actual de gestionar las validaciones carece de integridad con grandes áreas de oportunidad que se deben atender y solucionar.
¿Que son los registros?
Una parte importante para el control de datos es la estructuración sistemática de registros, tales cuales deben ser ordenados y monitorizados. Pero ¿Qué es un registro?
Un registro es toda la información de un elemento que se almacena en un archivo o tabla de base de datos; por ejemplo, el conjunto de datos debe incluir el nombre del producto, tipo de trabajo, dosis, categoría de método a evaluar, tipo de prueba, referencias de protocolos y vigencias. Así como quien y cuando se creó dicho registro. En algunos casos específicos un registro debe permitir la correlación de este con otros previamente realizados.
Como se mencionó los registros son identificadores únicos tales cuales están estructurados por prefijos, sufijos y números establecidos por algoritmos establecidos. De esta manera se da una secuencia definida sin posibilidad de duplicidad y con una completa trazabilidad mediante pistas de auditoría. Es importante considerar que los registros dentro de los sistemas computarizados e informatizados deben ser ordenados e identificados de manera secuencial para una búsqueda eficiente y un acceso rápido.
¿Nosotros como lo hacemos?
A continuación, te mostramos la secuencia de pasos que realiza nuestro sistema estrella para la creación, control y acceso a registros de validación de métodos analíticos. No obstante, te invitamos a revisar nuestros otros desarrollos, tales cuales cuentan también con estas funciones.
Vallamos entonces.
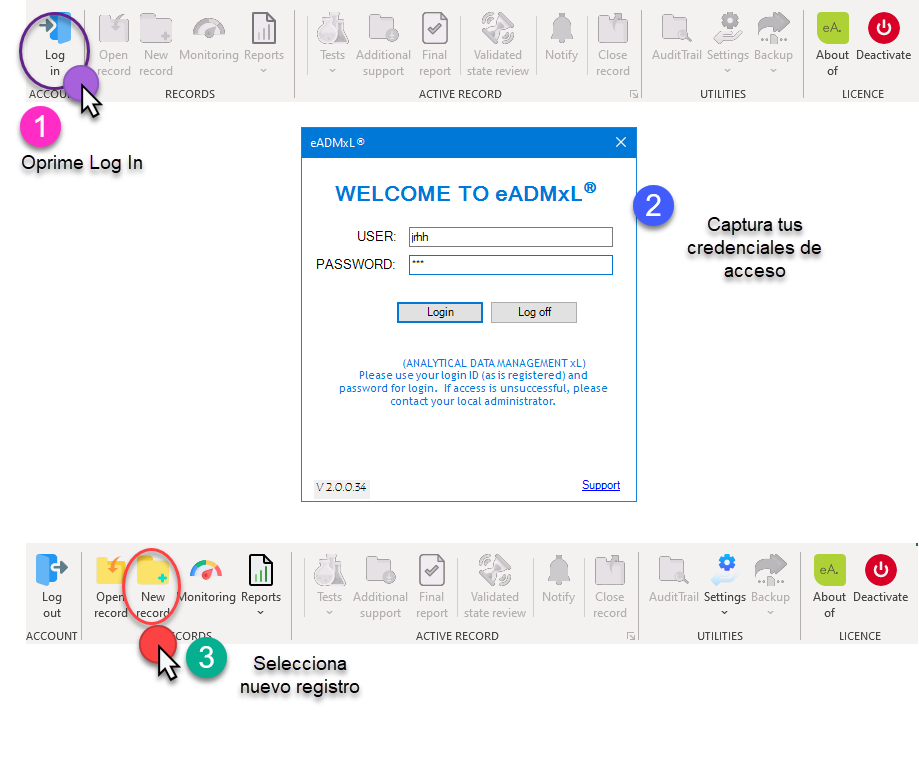
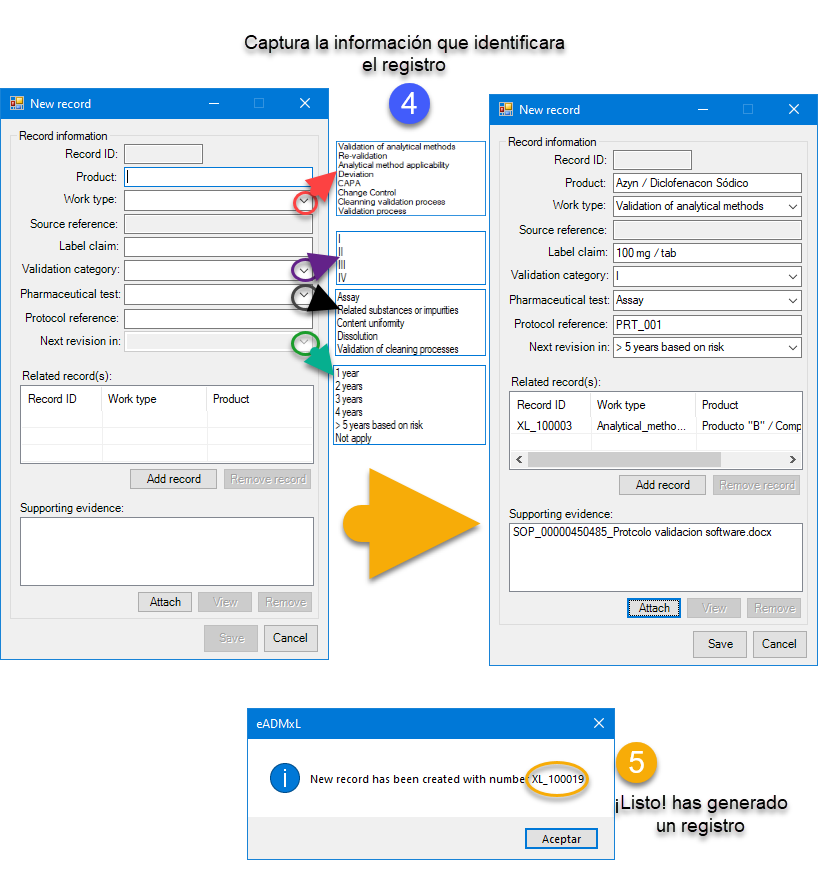
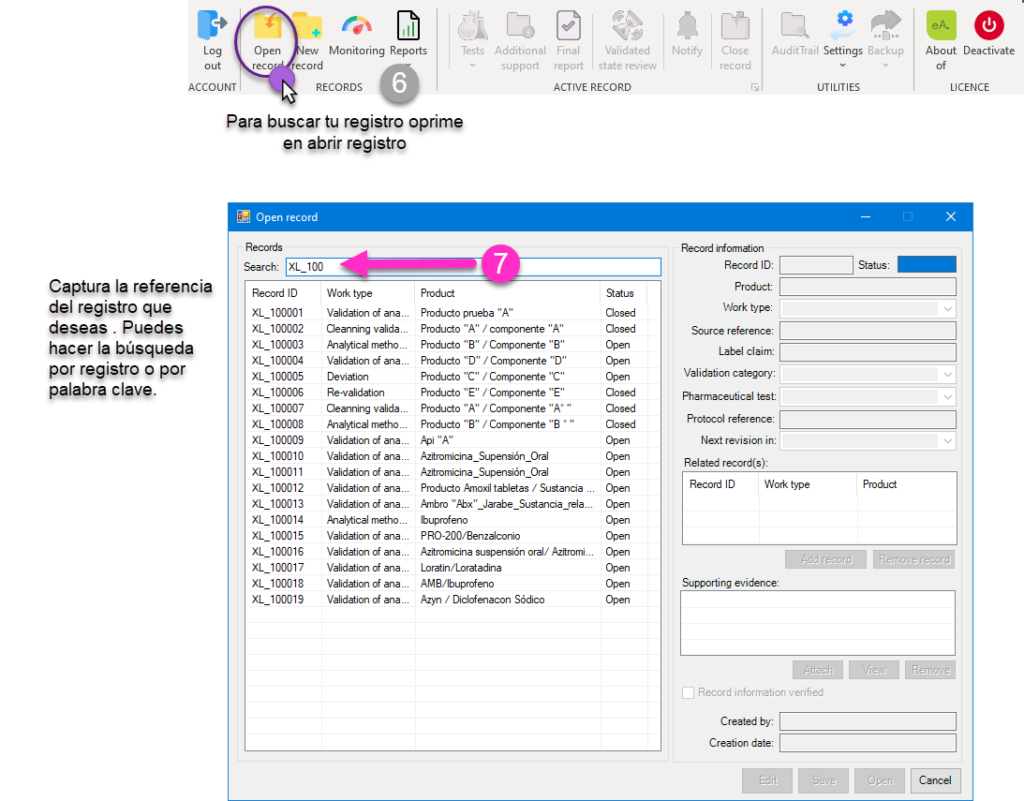
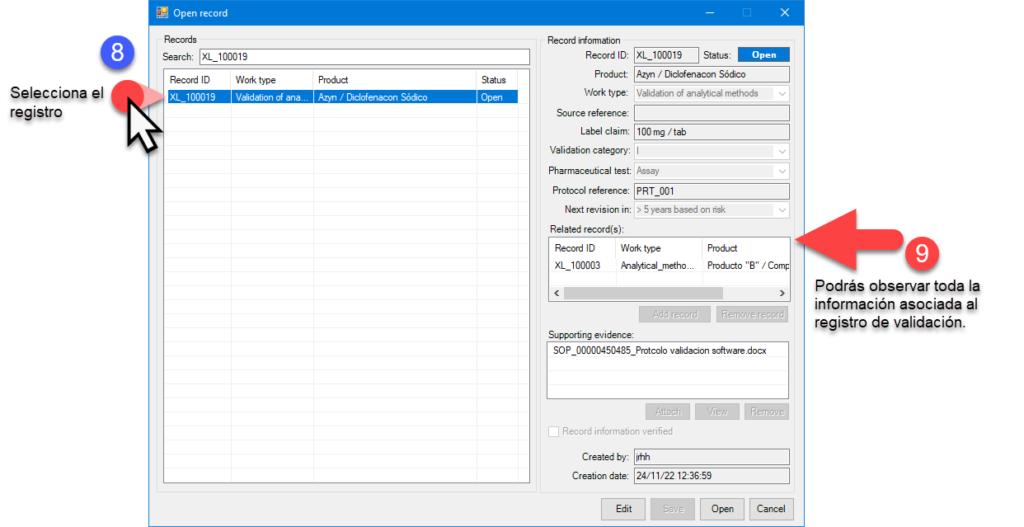
En la actualidad hay muchos gaps relacionados al acceso y control de sistemas computarizados (se incluyen hojas de cálculo). Es por esto que en deappharma desarrollamos herramientas que potencian tu cumplimiento de manera fácil y lógica. Te invitamos a conocer y solicitar tu DEMO y/o implementación de licencia gratuita de nuestro sistema estrella eADMxL para realizar el proceso de validación de métodos analíticos. También te invitamos a explorar nuestros otros desarrollos y visualizar en que proceso te podemos ayudar.
El cambio está en tus manos. Nosotros de ayudamos a potenciar tu cumplimiento.
Referencias:
- FDA draft guidance – Analytical Procedures and Methods Validation
- USP 31 –NF 26, Capítulo General Validación de métodos farmacopéicos
- Villareal de la Garza Sonia, Introducción a la computación. Cap 8 Ed. McGrawHill , México , 2007
¿Necesitas ayuda?
¡Contáctanos! y conoce de que manera te vamos a ayudar.
¡Únete a nuestra comunidad en redes!
