Revisión de estado validado de método analíticos.
Uno de los varios procesos de control analítico dentro de la industria, es el seguimiento o mantenimiento del estado validado y/o estado de control de métodos analíticos. No es una tarea fácil!! ya que para realizar una correcta revisión, el entorno en el que gira el proceso de mantenimiento validado radica en el acceso a documentos y en la obtención de datos que se asocian directamente a la esencia del método, como son: primera validación y parámetros de adecuabilidad históricos.
Concepto:
El concepto de ciclo de vida, vincula el desarrollo de productos y procesos, por lo que se debe adquirir conocimiento para abordar la revisión.
Validación métodos y calidad de los medicamentos.
La validación efectiva del método contribuye significativamente a asegurar la calidad de los medicamentos. Lo básico, es comprender el principio de garantía de calidad. Este principio describe que se debe producir un medicamento que sea apto para el uso previsto.
Este principio incorpora el entendimiento de que existen las siguientes condiciones:
a) La calidad, la seguridad y la eficacia están diseñadas o integradas en el producto.
b) La calidad no puede garantizarse adecuadamente simplemente mediante el producto en proceso y terminado, inspección o prueba.
Un programa de validación exitoso depende de la información y el conocimiento del método, así como, de la comprensión del proceso de desarrollo analítico. Este conocimiento es la base para establecer un enfoque para el control del analítico, que da como resultado certidumbre en la calidad y atributos evaluados. Los científicos analíticos deben:
- Comprender las fuentes de variación (se puede evaluar durante la validación o con la revisión de los datos de validación).
- Detectar la presencia y el grado de variación (análisis de datos obtenidos en la validación y en el histórico de datos de liberación, sin embargo, esto no mide directamente el método).
- Controlar la variación de una manera acorde con el riesgo, que representa para el método que afecta los datos de liberación del producto.
Descripción del proceso analítico en tres etapas:
Etapa 1 – Diseño del proceso analítico: el proceso analítico se define durante este etapa, basada en el conocimiento adquirido a través de actividades de desarrollo.
Etapa 2 – Validación del proceso analítico: durante esta etapa, el diseño analítico se evalúa para determinar si método es capaz de producir resultados reproducibles.
Etapa 3 – Verificación continua del proceso analítico: la garantía continua se obtiene durante la rutina analítica, de tal manera, que se pueda verificar que el proceso permanece en un estado de control.
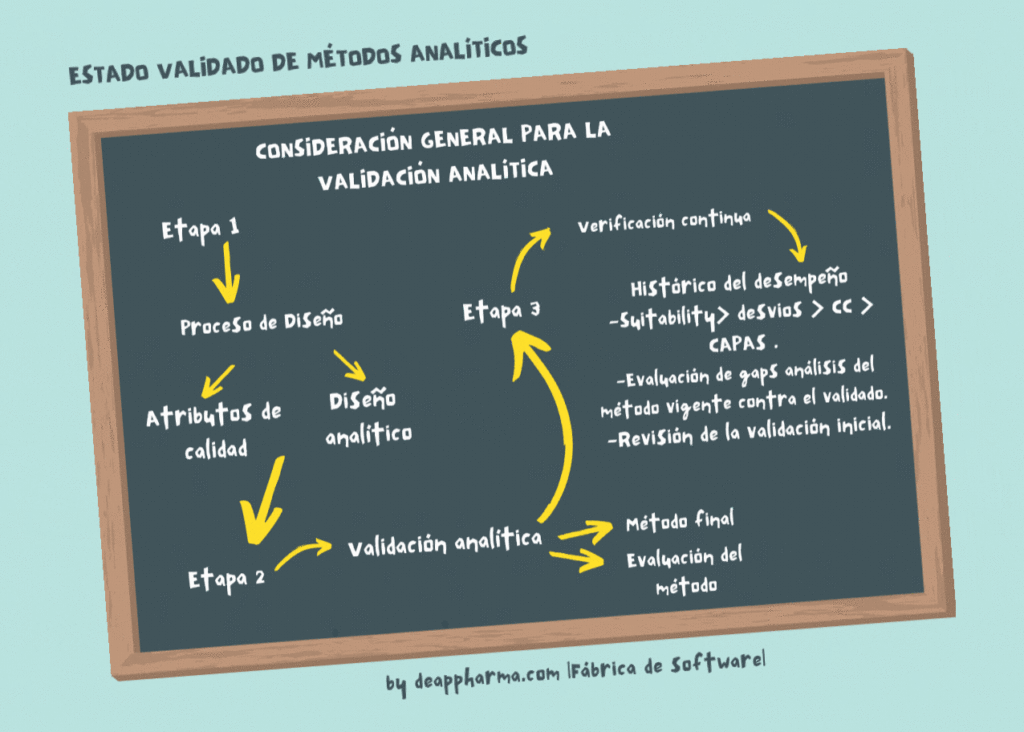
Los puntos relevantes de evaluación a la etapa 3, son:
- Requisitos de idoneidad históricos del sistema (platos teóricos, resolución, factor de coleo, factor de simetría, factor de capacidad y/o tiempos de retención de componentes).
- Parametrización y evaluación de las pruebas de desempeño acordes al método analítico.
- Revisión de los ajustes a las condiciones de operación indicadas en el procedimiento analítico vigente vs los descritos en la validación y/o transferencia inicial.
- Hallazgos o desviaciones, directamente relacionadas al desempeño del método analítico.
Si una evaluación basada en riesgos es utilizada como herramienta, se deben considerar otros factores. Los cuales pueden conducir a cambios en un procedimiento analítico y/o reemplazo con un nuevo método, se puede considerar los siguiente:
- Un ejercicio nuevo de transferencia;
- Una posible revalidación, sea parcial o total, o,un nuevo ejercicio de validación o,
- Un estudio de comparabilidad de métodos analíticos, es una opción factible.
En algunos casos, cambios en el fármaco o sustancias dentro del proceso de fabricación también deben ser evaluados como parte de la revisión de estado validado.
Recurso analítico «software».
Como se menciono anteriormente, la revisión de estado validado de un método analítico radica en que tan disponible y correcta fue la ejecución de este. Por lo que, la disposición de la información debe ser consistente. De otra manera será difícil concluir.
eADMxL el software de cumplimiento de deappharma.com , le ayudara con el control del proceso de estado validado mediante sus funciones especificas de «Revisión de estado validado» y «Monitoreo de vigencias».
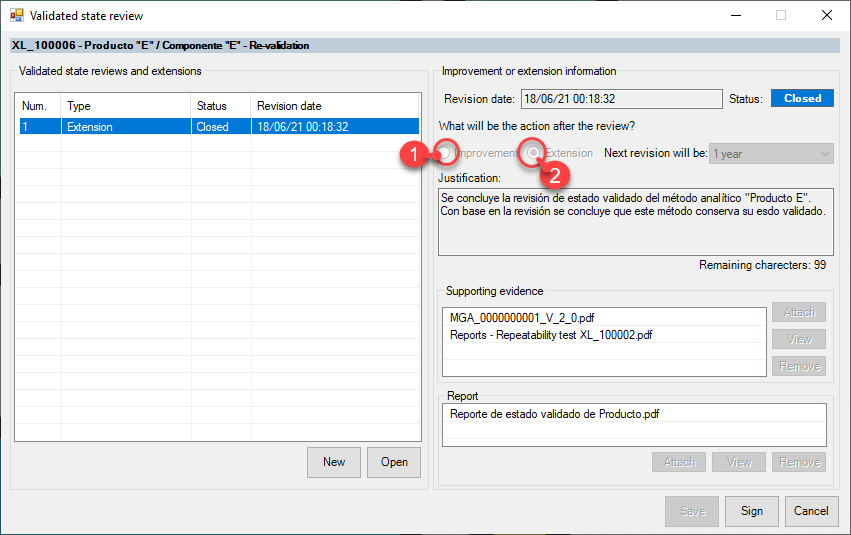
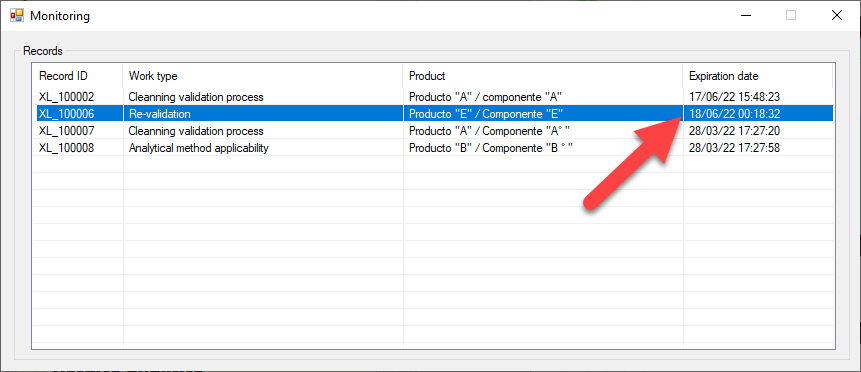
Algunas preguntas relevantes, que le ayudaran a definir el estado de control y/o mantenimiento, son:
- El método fue planteado y validado en concordancia con su categoría?
- La estadística paramétrica es integra?
- Los resultados de validación analítica son consistentes y claros?
- Si es un método compendial, los datos de pruebas de robustez tolerados están documentados?
- Los criterios de “Suitability” del sistema, se mantienen a través de los análisis?
- Las condiciones analíticas establecidas en el método final (preparación , condiciones de análisis, columna etc.) son las mismas que están descritas en el reporte de validación del método?
- Si hay cambios al método, se registran y se alinean a un control de cambio y se emite un CaPa al método y con esto evaluar el impacto a la validación?
- Qué tan recurrentes son las desviaciones o justificaciones asociadas al método analítico?
- Si la validación analítica sigue vigente, puedo hacer un revisión de estado validado antes de su fin expiración si surgen problemas?
No olvides que en caso de ser necesario, puedes contactarnos para mejorar el proceso de laboratorio y administrativo de tu organización a través software 100% confiable y seguro. Recuerda que en deappharma somos expertos en la materia, por lo que procesos complejos no representa un reto para nosotros, debido a que tenemos en mente los aspectos relevantes de cumplimiento.
Referencias.
- Analytical Procedures and Methods Validation for Drugs and Biologics Guidance for Industry
- Pharmaceutical quality system ICH Q10.
- Guidance for Industry Process Validation: General Principles and Practices.
¡Contáctanos! y conoce de que manera te vamos a ayudar.
¡Únete a nuestra comunidad en redes!
