Validación/Verificación de procedimientos analíticos enfoque EDQM
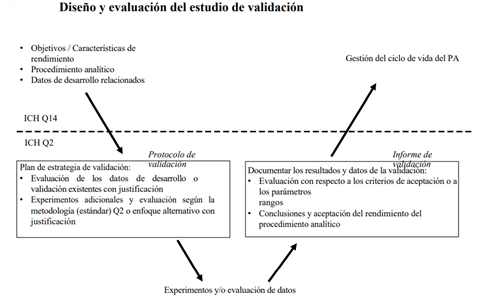
La directriz de la ICH sobre «Validación de procedimientos analíticos: Texto y Metodología» (Q2) constituye un análisis de las características de validación que deben tenerse en cuenta durante la validación de un procedimiento analítico (la directriz también se ha adoptado para los veterinarios durante el debate de la VICH). Se dirigen principalmente a la industria farmacéutica
indicando qué datos de validación deben proporcionarse en un expediente de solicitud. Estos datos deben demostrar que las pruebas y los criterios de aceptación propuestos están suficientemente controlados para garantizar una calidad reproducible de los productos en el momento de su comercialización y un control adecuado durante su vida útil (estabilidad).
Dado que las circunstancias en las que trabaja una OMCL son diferentes de las de una empresa farmacéutica – en la mayoría de los casos no se realizan análisis rutinarios, sino que a menudo las respuestas deben en un corto periodo de tiempo, es necesario reconsiderar el grado de validación/verificación antes de realizar un análisis. Por otra parte, en todos casos debe garantizarse que el resultado presentado es fiable. También hay que destacar que los materiales de referencia adecuados son un factor importante tanto para la realización de los los estudios de validación/verificación como en el propio análisis. El uso de preparados de referencia es ampliamente aceptado puede evitar en determinadas circunstancias la consideración de algunas
características de validación, sobre todo en el ámbito de los productos biológicos: esto debe justificarse caso por caso. El OMCL podrá decidir el alcance necesario teniendo en cuenta los factores de riesgo.
El ámbito de aplicación de este documento -dirigido específicamente a los OMCL- es orientar sobre el alcance de la validación/verificación necesaria, en función de diversas circunstancias, es decir, el objetivo del análisis (por ejemplo, detección de incumplimiento), la cantidad de datos de validación ya disponibles (por ejemplo, en caso de transferencia de un método), la experiencia o los datos históricos ya disponibles en el OMCL individual (por ejemplo, recuperación a partir de una matriz compleja; uso rutinario de una valoración estándar incluso si se valoran sustancias diferentes), etc.
Este documento es igualmente aplicable a productos de origen sintético y biológico. No aborda las prácticas habituales de laboratorio: por ejemplo, orientaciones relativas al uso del equipo, calibración, etc.
Este documento es una nota orientativa que ofrece recomendaciones detalladas sobre el de validación/verificación en función de la categoría del procedimiento analítico; cabe señalar que siempre son posibles otros enfoques. Con respecto a la nueva Directiva 2010/63/UE relativa a la utilización ética de los animales para fines científicos y educativos y el convenio europeo sobre protección de los animales vertebrados utilizados para experimentación y Otros Fines Científicos (Consejo de Europa) es necesario prestar especial atención al uso de métodos in vivo como procedimientos analíticos. Debe hacerse todo lo posible para racionalizar y racionalizar y restringir al mínimo necesario la utilización de animales sobre la base de un análisis exhaustivo de la situación.
Cabe destacar que este documento no puede ofrecer asesoramiento detallado para todos los casos posibles en los que se utilicen ensayos in vivo. El propósito de este documento es proporcionar una orientación general. En todos los casos, deberá incluirse una breve descripción y/o justificación del enfoque elegido, incluidos los métodos, deberá describirse en la documentación interna del análisis.
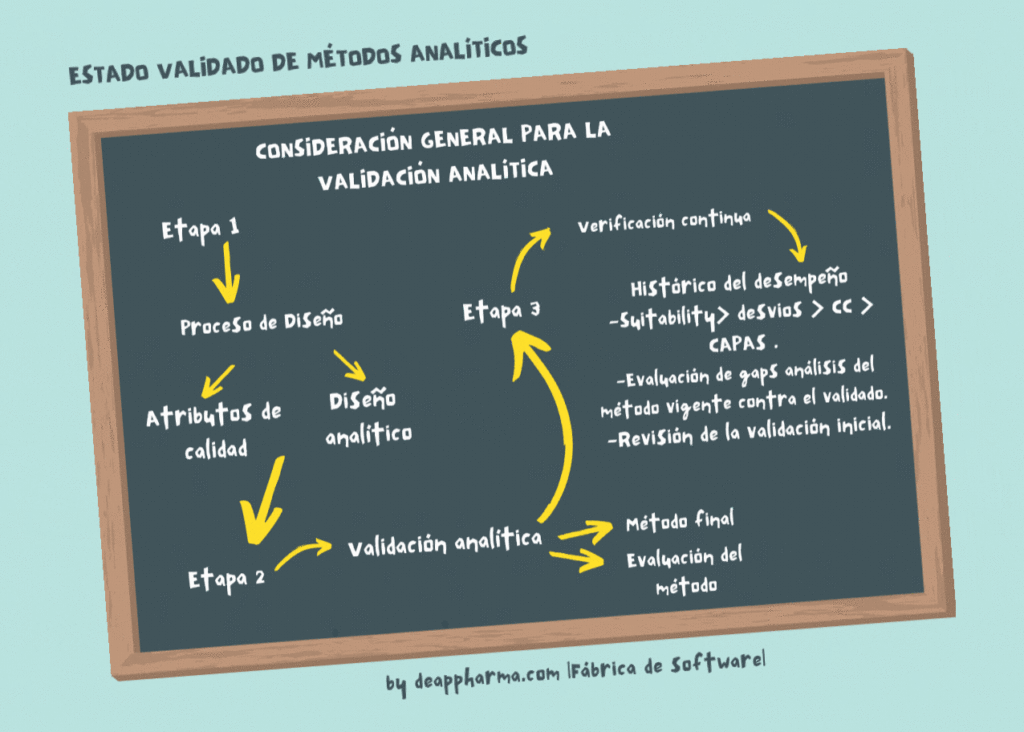
Datos de validación
Deberán justificarse las modificaciones del método validado original. En función de la naturaleza de las modificaciones y del resultado de la evaluación del riesgo, podrán emprenderse actividades de validación o verificación suplementarias. Se aplicarán las mismas definiciones que en el documento ICH.
Categorías de análisis
En este capítulo se definen las diferentes situaciones analíticas (categorías) que pueden darse en un OMCL y las características de validación correspondientes que deben tenerse en cuenta. Consulte la versión actual de la directriz ICH sobre «Validación de procedimientos analíticos»: Text and Methodology» (Q2).
Los estudios formales de validación, de acuerdo con los requisitos de la ICH, deben llevarse a cabo cuando se desarrolle un nuevo método, cuando se utilice un método existente o cuando los datos de validación de un método existente deban completarse.
Según la norma ISO 17025, la validación es necesaria para los métodos no normalizados. .En el contexto de la OMCL, los métodos de farmacopea y los métodos validados de una autorización de comercialización se consideran métodos estándar.
La verificación del método debe realizarse para demostrar que en las condiciones reales de uso en los laboratorios individuales el método (validado) es adecuado (apto para su uso). Esto puede lograrse realizando las pruebas de idoneidad del sistema (por ejemplo, la resolución en un método cromatográfico) el control de la sensibilidad en el umbral de notificación, el control de la integridad de un paso de reacción (por ejemplo, extracción, reacción de hidrólisis) antes de que pueda realizarse la determinación propiamente dicha, verificar la precisión del método, etc. Esto también puede lograrse realizando un ejercicio de transferencia del método, en el laboratorio que ha establecido el método y el OMCL y comparando los resultados para demostrar la equivalencia. En todos los casos, se incluirá una breve nota en la que se expliquen los motivos del método elegido (en función de la complejidad del análisis requerido). La complejidad del análisis requerido-, deberá incluirse en la documentación interna del análisis. Las desviaciones de esta directriz deberán justificarse.
En las tablas 1 a 8 se contemplan varias categorías de análisis:
Tabla 1: Método publicado en la Farmacopea Europea
Los procedimientos analíticos descritos en una monografía se consideran validados. El OMCL debe verificar que todos los materiales de referencia necesarios y que se realizan las pruebas de idoneidad del sistema requeridas. Para las pruebas de sustancias relacionadas, la especificidad para cualquier impureza conocida que no figure en la monografía (por ejemplo, la lista de transparencia Ph Eur). Para las monografías de productos terminados, el OMCL debe verificar que ningún excipiente interfiera en el análisis de la sustancia activa, a menos que se indique contrario en la monografía.
Nota: Para entrar en esta categoría, los procedimientos deben ser descritos en detalle, no por ejemplo como en algunos casos para biológicos donde hay sólo una descripción general del método. Los detalles pueden proceder del informe publicado del estudio colaborativo (por ejemplo, los informes de estudios BSP en Pharmeuropa Bio & Scientific notes)
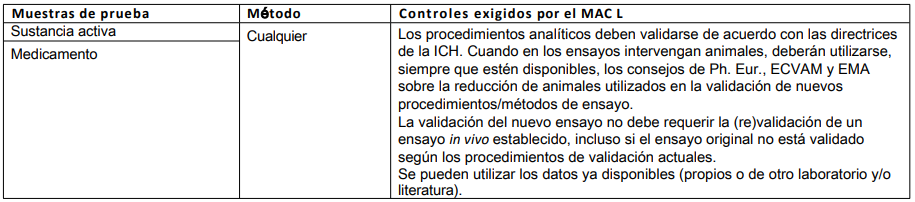
Tabla 2: Método validado de un fabricante (1ª autorización de comercialización)
Los procedimientos analíticos tomados de una autorización de comercialización están totalmente validados por la empresa.
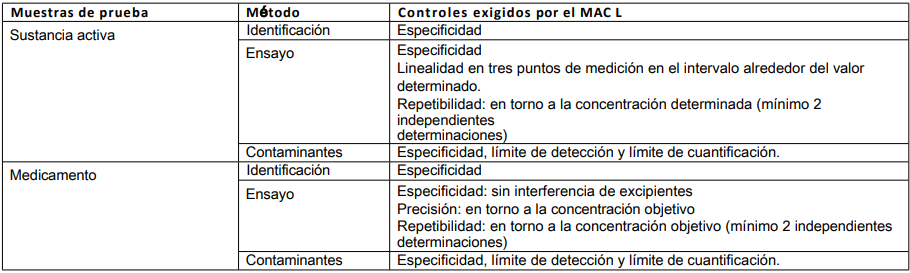
1er MAH = producto fabricado por el MAH que validó el método original utilizado. 2º HAC = producto de un fabricante diferente
para el que no se ha validado específicamente el método original utilizado.
Cuando los métodos procedan de un expediente o expedientes de solicitud antiguos sin datos de validación o con datos insuficientes, se deberá informar a la Autoridad Competente supervisora. Para las características de validación que deben tenerse en cuenta, véanse las tablas 2, 5.
Tabla 3: Método publicado no compendial
Las características de validación a considerar dependerán siempre de la cantidad de datos de validación aportados. Si el método ha sido completamente validado y los datos se han publicado en la bibliografía, véase el cuadro 1. En caso contrario, deberá tenerse en cuenta lo siguiente.
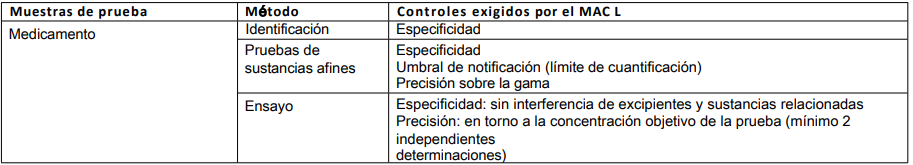
Tabla 4: Método de sustancia activa utilizado para un medicamento
El principal factor a considerar aquí es la influencia de la matriz en el análisis, incluyendo la interferencia de los excipientes.
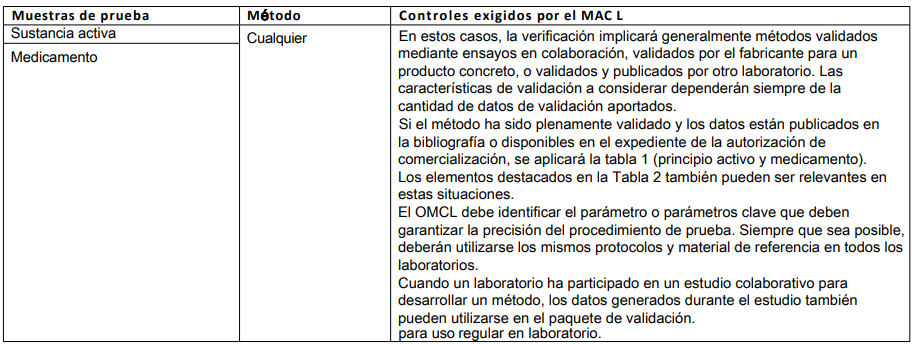
Tabla 5: Métodos validados para reducir, perfeccionar o sustituir el uso de animales (3R)
Tabla 6: Detección de incumplimientos
El cribado de la no conformidad significa que el objetivo del análisis es detectar la posible no conformidad del producto con las especificaciones.
Este tipo de cribado se realizaría cuando se solicita un análisis rápido y/o cuando no se dispone de datos de validación del método. El procedimiento debe documentarse en todos los casos.
Si se detecta un incumplimiento, debe ampliarse el alcance de la validación, por ejemplo, considerando la posibilidad de cambiar a un método bien reconocido (método de compendio o método del expediente MAH).
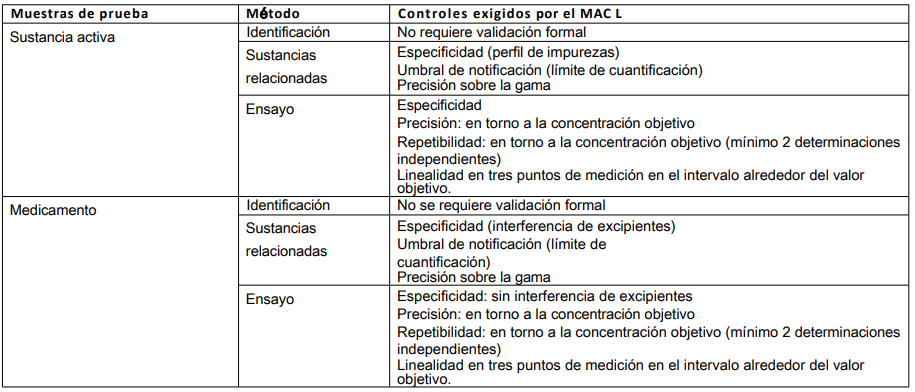
Tabla 7: Detección de productos/contaminantes desconocidos
En estos casos, se carece de información sobre el producto que debe analizarse con respecto a su declaración en la etiqueta (presencia o ausencia de determinadas sustancias) o para aclarar otros aspectos solicitados por la Inspección.
Pruebas a tener en cuenta: identificación, ensayo y, tal vez, pruebas de pureza. El primer paso importante es identificar los principales componentes del producto.
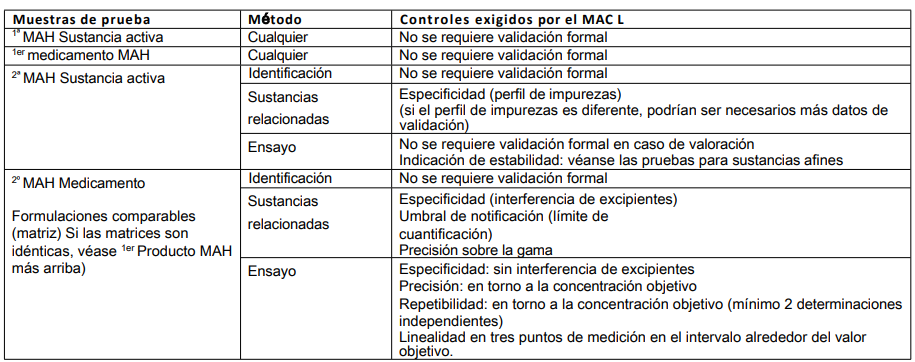
Tabla 8: Desarrollo de un nuevo método
Esto ocurre principalmente cuando un producto se prueba en condiciones de ensayo rutinarias y/o cuando se utiliza un procedimiento analítico interno.

¿Existen herramientas en el mercado que mejoren los procesos administrativos y de laboratorio?
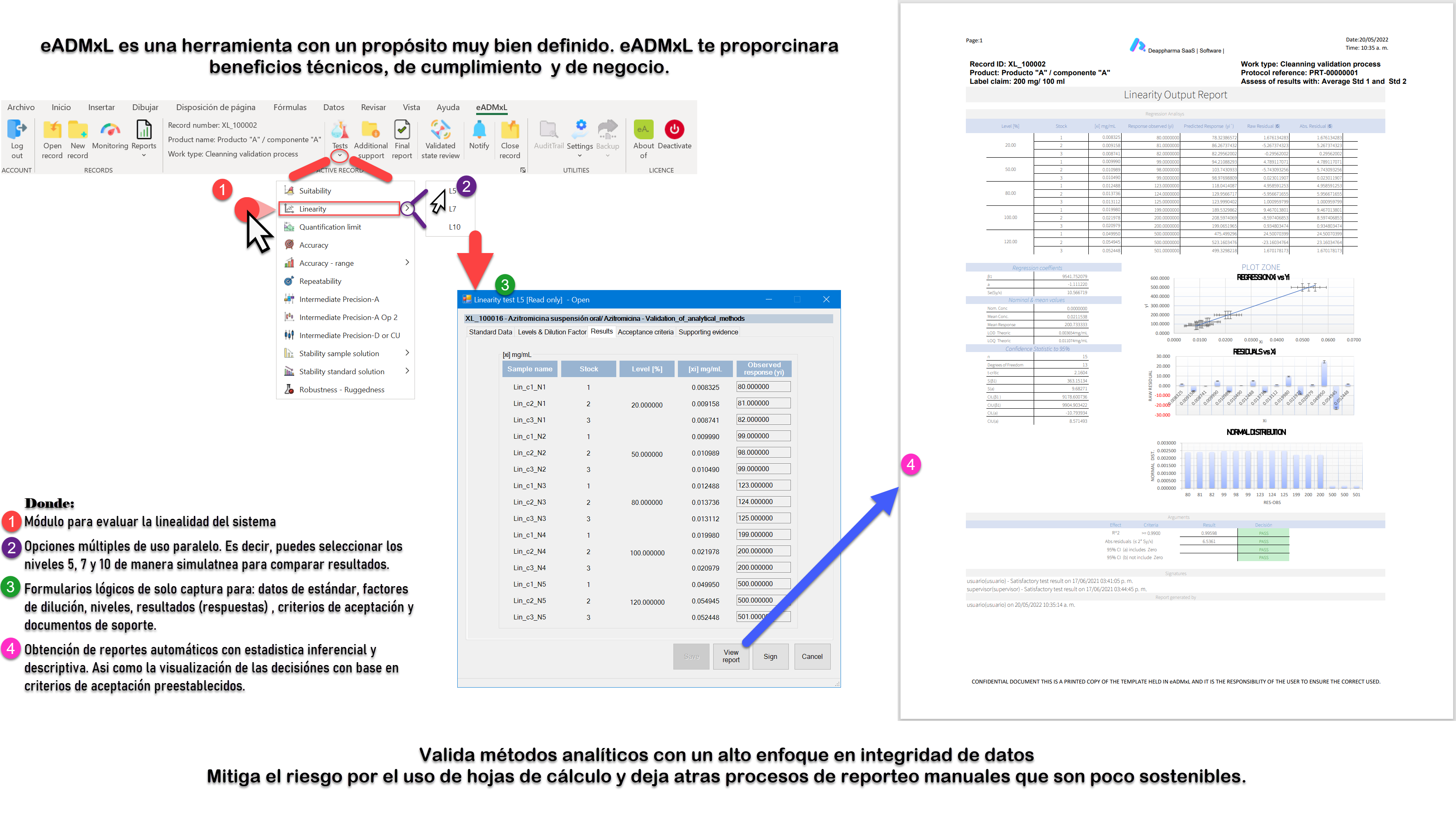
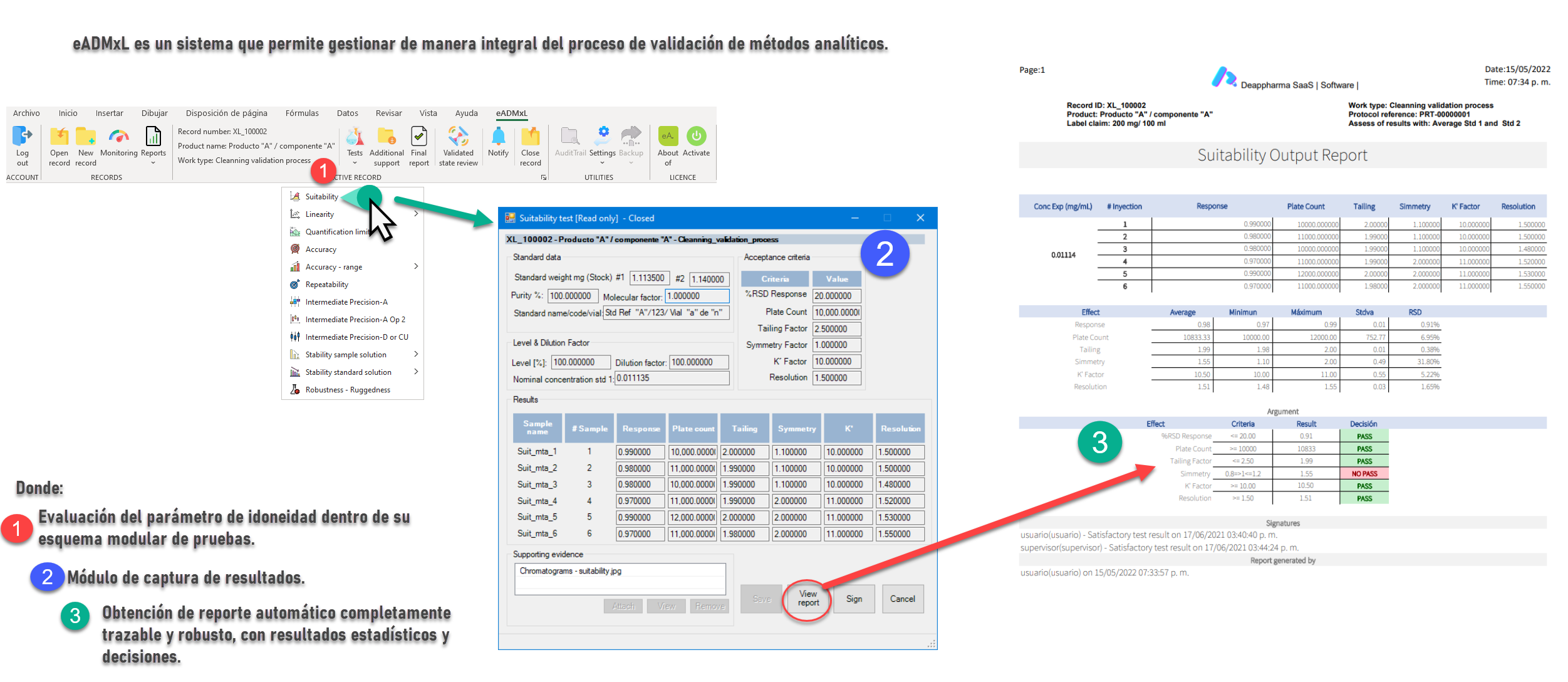
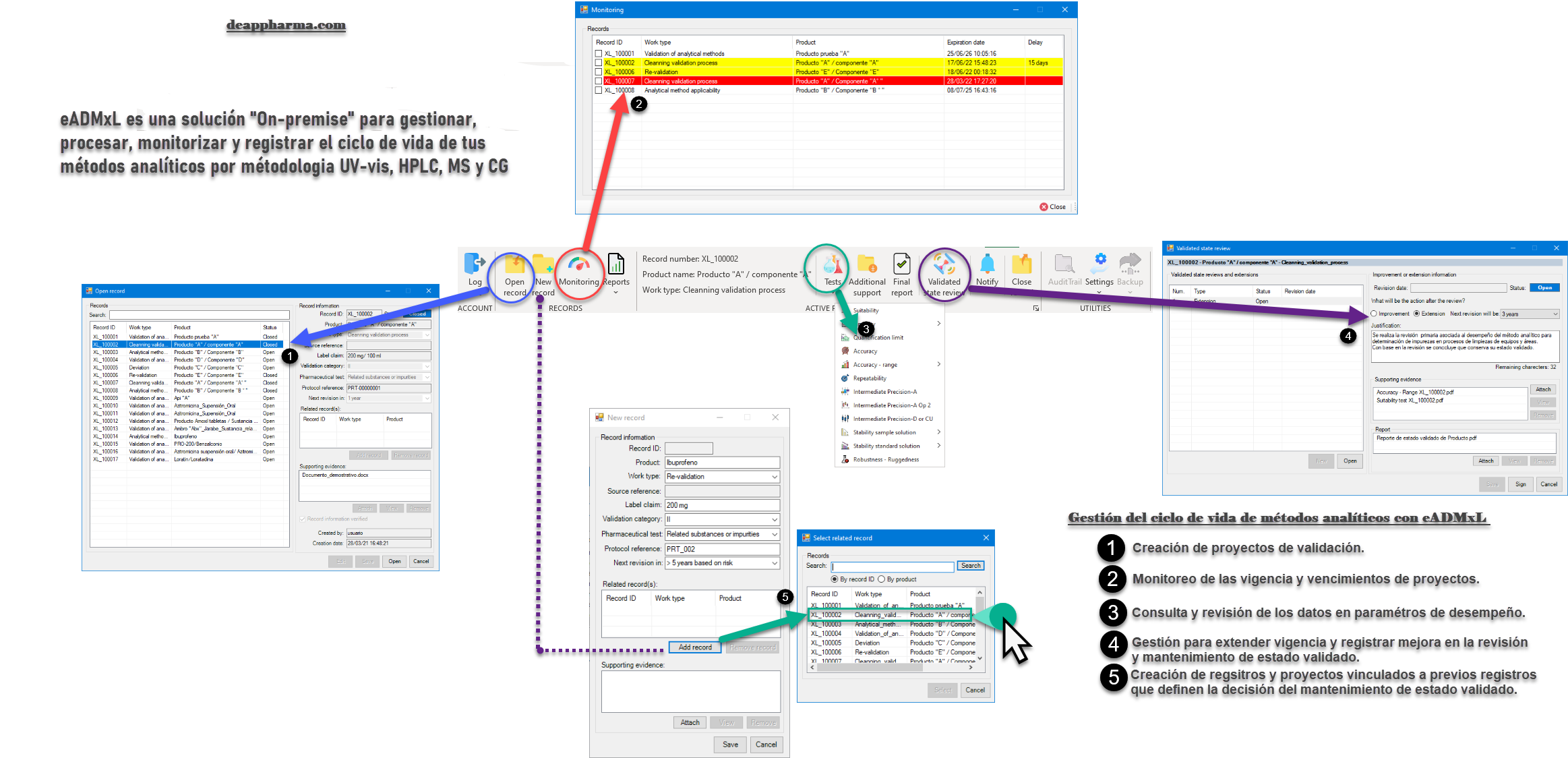
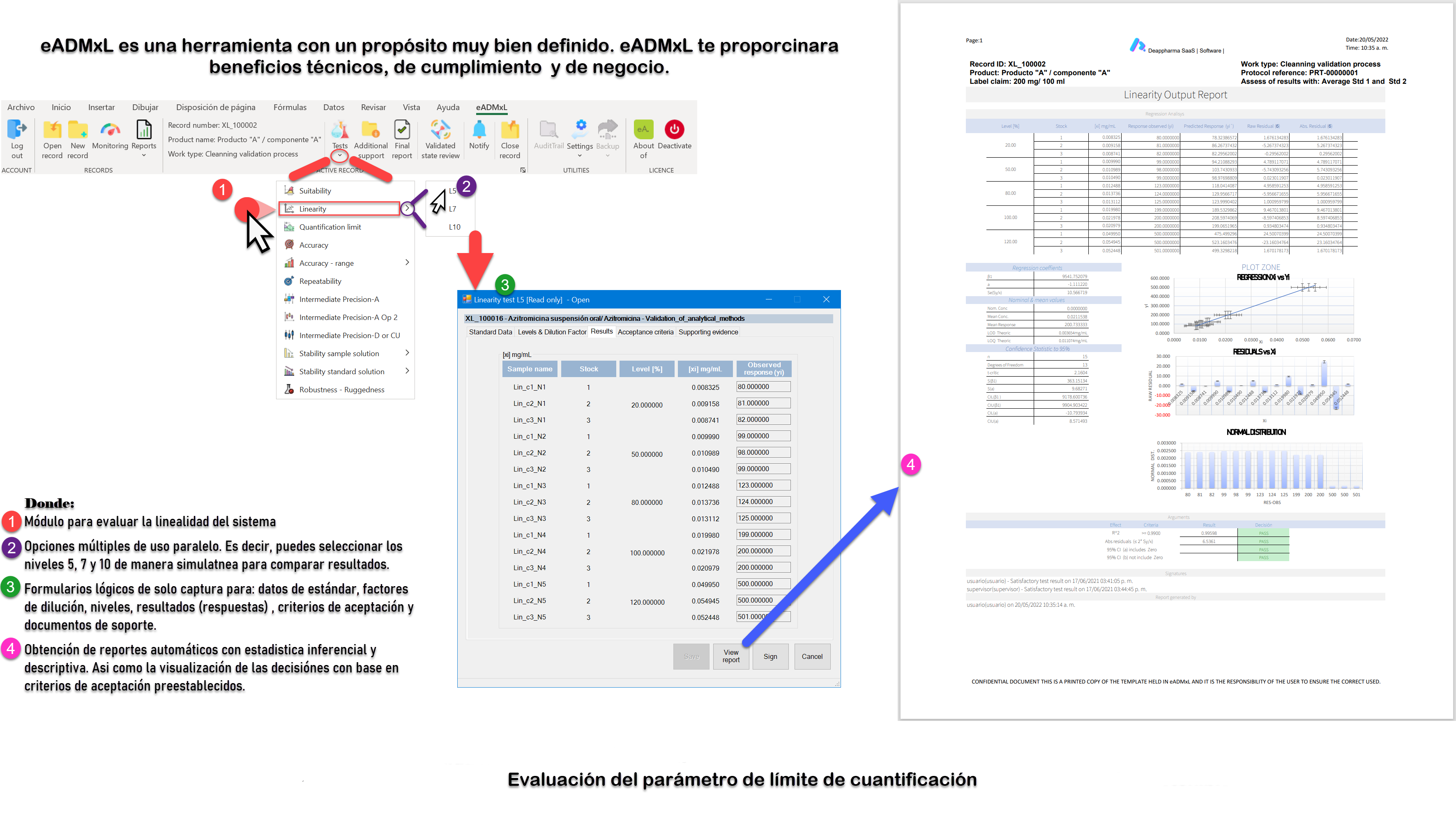
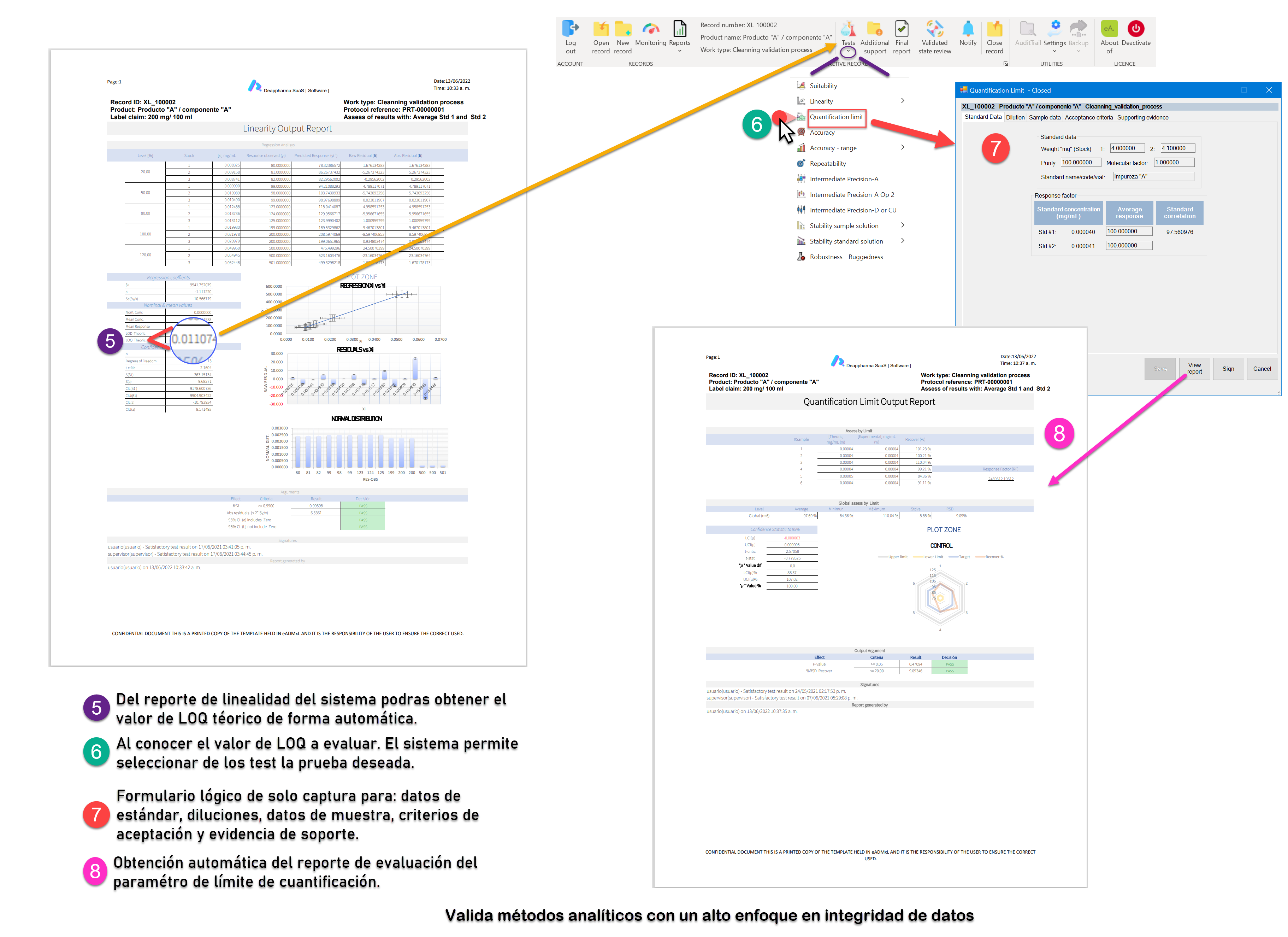
Como bien sabemos el desafío más grande al que se a puesto a prueba el sector farmacéutico es el relacionado con la integridad de datos. Y el proceso de validación de método analíticos no cae fuera de este requerimiento ¡Pero! ¿Por qué es tan complejo este tema? La respuesta se deriva por la gran cantidad de datos y documentos que se emiten día con día en el que se ven impactados documentos y libros de Excel.
Recordemos que la validación de software y libros de Excel es el primer paso. No obstante, muchos libros de Excel utilizados en el sector farmacéutico no cuentan con evidencia de validación lo cual es un riesgo que podrá derivar en un hallazgo critico ante una inspección regulatoria.
El segundo paso y el más complejo es adherir las configuraciones necesarias que eleven la integridad de datos y favorezcan el mantenimiento tanto de software como de Libros de Excel.
Te invitamos a mitigar el riesgo por el uso de sistemas computarizados no validados y con pobres atributos de integridad de datos. Nuestros desarrollos están estructurados bajo un sistema de gestión de calidad trazable y auditable. Tales cuales cuentan con el soporte de validación-calificación documental con base en Gamp 5 y CFR21 parte 11.
Conoce eADMxL el cual es un software que desarrollamos para mitigar el uso de hojas de cálculo para procesos de validación de métodos analíticos. Conoce sus beneficios y alcance general aquí: ¡Da clic aquí!
“No vivas con el riesgo ¡Mitígalo!” para eso nosotros de ayudamos.
Visita nuestro sitio www.deappharma.com y solicita una demostración y asesoría gratuita.
¡Contáctanos! y conoce de que manera te vamos a ayudar.
¡Únete a nuestra comunidad en redes!
Referencias
- General European OMC L Network (GEON) Quality Management Document
- Validation of analitycal procedures :text and methodology Q2